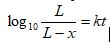CHẤT LƯỢNG NƯỚC – XÁC ĐỊNH NHU CẦU OXY SINH HÓA SAU n NGÀY (BODn) – PHẦN 1: PHƯƠNG PHÁP PHA LOÃNG VÀ CẤY CÓ BỔ SUNG ALLYLTHIOUREA TIÊU CHUẨN QUỐC GIA TCVN 6001-1: 2008
Water quality – Determination of biochemical oxygen demand after n days (BODn) – Part 1 : Dilution and seeding method whith allylthiourea addition
Lời nói đầu
TCVN 6001-1 : 2008 và TCVN 6001-2 : 2008 thay thế TCVN 6001 : 1995.
TCVN 6001-1 : 2008 hoàn toàn tương đương với ISO 5815-1 : 2003.
TCVN 6001-1 : 2008 do Ban kỹ thuật tiêu chuẩn TCVN/TC 147 "Chất lượng nước" biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
TCVN 6001 Chất lượng nước – Xác định nhu cầu oxy sinh hóa sau n ngày (BODn) gồm hai tiêu chuẩn sau:
- TCVN 6001-1 : 2008 (ISO 5815-1 : 2003) Phần 1 : Phương pháp pha loãng và cấy có bổ sung allythioure;
- TCVN 6001-2 : 2008 (ISO 5815-2 : 2003) Phần 2 : Phương pháp dùng cho mẫu không pha loãng.
Lời giới thiệu
Tiêu chuẩn này là bản cải tiến của TCVN 6001 : 1995, Chất lượng nước – Xác định nhu cầu oxy sinh hóa sau 5 ngày (BOD5) – Phương pháp pha loãng và cấy.
Thời gian ủ quy định trong tiêu chuẩn này là năm ngày, giống như trong TCVN 6001 : 1995 (ISO 5815 : 1989) và như đã áp dụng ở nhiều nước Châu Âu, hoặc bảy ngày như đã áp dụng ở các nước Bắc Âu trong nhiều năm. Thời gian ủ bảy ngày nói chung cho kết quả BOD cao hơn ủ năm ngày.
Thời gian ủ năm ngày, có thể tránh được phải làm việc vào những ngày nghỉ cuối tuần nếu lấy mẫu vào các ngày thứ thư, thứ năm hay thứ sáu. Khi thời gian ủ bảy ngày, có thể phân tích những mẫu được lấy vào những ngày đầu tiên trong tuần mà không phải làm việc vào ngày nghỉ cuối tuần. Vì thế thời gian ủ bảy ngày được xem là thuận tiện hơn ủ năm ngày.
Phương pháp ủ bảy ngày mới được mô tả trong Phụ lục A. Các điều tra nghiên cứu kết quả BOD thu được theo phương pháp mới này hoàn toàn tương đương với kết quả BOD ủ sau năm ngày được mô tả trong phần chính của tiêu chuẩn này. Hy vọng rằng có nhiều số liệu so sánh thu được giữa hai phương pháp ủ trong những năm tới để phương pháp ủ bảy ngày được nhìn nhận đầy đủ hơn trong tiêu chuẩn này.
Để xác định BODn của mẫu nước, có thể dùng phương pháp máy thở mô tả trong TCVN 6827 (ISO 9408).
Trong tiêu chuẩn này, giói hạn xác định DL được tính theo công thức sau:
(1)
Trong đó:
se là độ lệch chuẩn của dãy xác định;
t0,95(f) là giá trị t phân bố Student;
f là số bậc tự do để xác định sB;
n là số lần phân tích để xác định mẫu trắng trong dãy phân tích;
sB được tính theo số mẫu có hàm lượng BOD gần với DL ước tính.
Trong trường hợp phương pháp phân tích không yêu cầu hiệu chỉnh mẫu trắng thì bỏ qua thành phần
.. (2)
CHẤT LƯỢNG NƯỚC – XÁC ĐỊNH NHU CẦU OXY SINH HÓA SAU N NGÀY (BODN) – PHẦN 1 : PHƯƠNG PHÁP PHA LOÃNG VÀ CẤY CÓ BỔ SUNG ALLYLTHIOUREA
Water quality – Determination of biochemical oxygen demand after n days (BODn) – Part 1: Dilution and seeding method whith allylthiourea addition
Cảnh báo – Người dùng tiêu chuẩn này cần phải thành thạo với thực hành trong phòng thí nghiệm thông thường. Tiêu chuẩn này không đề cập đến mọi vấn đề an toàn liên quan đến người sử dụng. Trách nhiệm của người sử dụng là phải xác lập độ an toàn, đảm bảo sức khỏe và phù hợp với các quy định của quốc gia.
Tiêu chuẩn này quy định phương pháp xác định nhu cầu oxy sinh hóa của nước bằng phương pháp pha loãng và cấy các tác nhân gây ức chế quá trình nitrat hóa.
Phương pháp này áp dụng được cho các loại nước có nhu cầu oxy sinh hóa lớn hơn hoặc bằng 3 mg/l oxy (giới hạn xác định) và không vượt quá 6 000 mg/l oxy, nhưng sai số do pha loãng có thể ảnh hưởng đến kết quả phân tích của phương pháp và đòi hỏi xử lý kết quả phải thận trọng.
Kết quả thu được là sản phẩm kết hợp của các phản ứng hóa học và sinh hóa. Kết quả này không thể hiện đặc tính chặt chẽ và rõ ràng của phản ứng do một quá trình hóa học đơn lẻ, đã xác định rõ tạo ra. Tuy nhiên, chúng cung cấp một chỉ thị để dựa vào đó có thể ước tính được chất lượng nước.
Phép thử có thể bị ảnh hưởng do sự có mặt của các chất khác nhau. Tính chất của các chất này là độc đối với vi sinh vật, ví dụ thuốc diệt khuẩn, các kim loại độc, clo tự do sẽ ức chế oxy hóa sinh hóa. Sự có mặt của tảo hoặc vi sinh vật nitro hóa có thể tạo ra kết quả cao phi tự nhiên.
Phụ lục A mô tả thông tin về thời gian ủ tương ứng.
Phụ lục B mô tả nhiều phép thử có thể sử dụng để tăng độ chính xác hoặc để phát hiện sự có mặt của các chất độc hại đối với vi sinh vật.
Phụ lục C cung cấp số liệu độ chụm.
Các tài liệu viện dẫu sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nên. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất (bao gồm cả sửa đổi).
TCVN 4851-89 (ISO 3696 : 1987) Nước dùng để phân tích trong phòng thí nghiệm – Yêu cầu kỹ thuật và phương pháp thử;
TCVN 6186 : 1996 (ISO 8467 : 1993) Chất lượng nước – Xác định chỉ số permanganat.
TCVN 6491 : 1999 (ISO 6060 : 1989) Chất lượng nước – Xác định nhu cầu oxy hóa học.
TCVN 6634 : 2000 (ISO 8245 : 1999) Chất lượng nước – Xác định tổng cacbon hữu cơ (TOC) và cacbon hữu cơ hòa tan (DOC).
TCVN 7324 : 2004 (ISO 5813 : 1983) Chất lượng nước – Xác định oxy hòa tan – Phương pháp iod.
TCVN 7325 : 2004 (ISO 5814 : 1990) Chất lượng nước - Xác định oxy hòa tan – Phương pháp thử điện hóa.
Trong tiêu chuẩn này áp dụng những thuật ngữ và định nghĩa sau:
3.1. Nhu cầu oxy sinh hóa sau n ngày (biochemical oxygen demand after n days)
BODn
Nồng độ khối lượng của oxy hòa tan bị tiêu thụ do quá trình oxy hóa sinh học của các chất hữu cơ và/hoặc vô cơ trong nước ở các điều kiện xác định, trong đó n là thời gian ủ bằng năm ngày hoặc bảy ngày.
CHÚ THÍCH 1 Chấp nhận theo TCVN 5981 (ISO 6107-2)
CHÚ THÍCH 2 Trong tiêu chuẩn này, “sự oxy hóa sinh hóa” được hiểu là “sự oxy hóa sinh học”.
Điều quan trọng là phép thử tiến hành theo tiêu chuẩn này cần được thực hiện bởi những nhân viên được đào tạo phù hợp.
Mẫu nước cần phân tích được xử lý sơ bộ và pha loãng với những lượng khác nhau của một loại nước loãng giàu oxy hòa tan và chứa các vi sinh vật hiếu khí, có ức chế sự nitrat hóa.
Ủ mẫu ở nhiệt độ 20 °C trong một thời gian xác định, năm ngày hoặc bảy ngày, ở chỗ tối, trong bình đầy và nút kín. Xác định nồng độ oxy hòa tan trước và sau khi ủ. Tính khối lượng oxy tiêu tốn trong một lít mẫu.
Chỉ dùng các thuốc thử tinh khiết phân tích được công nhận
5.1. Nước, nước loại 3 theo phân loại trong TCVN 4581 (ISO 3696).
Nước không được chứa nhiều hơn 0,01 mg/l đồng, không chứa clo hoặc cloramin.
5.2. Nước cấy, nếu bản thân mẫu nước không có đủ các vi sinh vận cần thiết, phải tạo ra nước cấy theo một trong các cách sau:
a) Nước thải đô thị có COD tối đa là 300 mg/l [nhu cầu oxy hóa học đo theo TCVN 6491 (ISO 6060) hoặc TOC tối đa là 100 mg/l [cacbon hữu cơ tổng số đo theo TCVN 6634 (ISO 8245), lấy từ cống chính hoặc từ cống của một khu dân cư không bị ô nhiễm đáng kể do công nghiệp. Gạn và lọc thô;
b) Nước sông hoặc hồ có chứa nước thải đô thị;
c) Nước thải đã xử lý của nhà máy xử lý nước thải được để lắng;
d) Nước lấy ở cuối dòng thải của chính loại nước cần phân tích hoặc nước chứa vi sinh vật thích hợp cho nước cần phân tích và được nuôi cấy trong phòng thí nghiệm (với trường hợp là nước thải công nghiệp có chứa các chất khó phân hủy);
e) Nguyên liệu nuôi cấy có bán sẵn trên thị trường.
5.3. Dung dịch muối, bảo quản trong bình thủy tinh ở nhiệt độ 0 °C đến 4 °C trong chỗ tối.
Các dung dịch sau đây bền trong sáu tháng. Cần được loại bỏ ngay khi có dấu hiệu kết tủa hoặc sinh vật phát triển.
5.3.1. Dung dịch đệm photphat, pH 7,2.
Hòa tan 8,5 g kali dihydrophotphat (KH2PO4), 21,75 dikali hydrophotphat (K2HPO4), 33,4 g dinatri hydrophotphat heptahydrat (Na2HPO4.7H2O) và 1,7 g amoni clorua (NH4Cl) trong khoảng 500 ml nước. Pha loãng đến 1 000 ml và lắc đều.
Nếu pH của dung dịch đệm này là 7,2 thì không cần điều chỉnh.
5.3.2. Dung dịch magie sulfat heptahydrat, p = 22,5 g/l.
Hòa tan 22,5 g magie sulfat heptahydrat (MgSO4.7H2O) trong nước. Pha loãng thành 1 000 ml và lắc đều.
5.3.3. Dung dịch canxi clorua, p = 27,5 g/l.
Hòa tan 27,5 g canxi clorua khan (CaCl2) hoặc tương đương (ví dụ sử dụng 36,4 g muối canxi clorua ngậm nước (CaCl2.2H2O) với nước. Pha loãng thành 1 000 ml và lắc đều.
5.3.4. Dung dịch sắt (III) clorua hexahydrat, p = 0,25 g/l.
Hòa tan 0,25 g sắt (III) clorua hexahydrat (FeCl3.6H2O) trong nước. Pha loãng thành 1 000 ml và lắc đều.
5.4. Nước pha loãng
Thêm 1 ml mỗi dung dịch muối (5.3.1, 5.3.2, 5.3.3 và 5.3.4) vào khoảng 500 ml nước. Pha loãng thành 1000 ml và lắc đều. Giữ nhiệt độ 20 °C ± 2 °C cho dung dịch vừa điều chế được và giữ ở nhiệt độ này, sục khí ít nhất trong 1 h bằng dụng cụ thích hợp. Chú ý không làm nhiễm bẩn dung dịch (6.8), đặc biệt là nhiễm bẩn các chất hữu cơ, kim loại, chất oxy hóa hoặc chất khử, để đảm bảo nồng độ oxy hòa tan ít nhất là 8 mg/l.
Tránh làm cho nước quá bão hòa oxy: mở nút bình chứa và để trong 1 h trước khi sử dụng. Dung dịch chỉ được dùng trong vòng 24 h tính từ lúc chuẩn bị, phần còn lại của dung dịch sau thời gian đó phải đổ bỏ, ngoại trừ thực tế phòng thí nghiệm hoặc các giá trị kiểm tra cho thấy là dung dịch nước đó dùng được trong khoảng thời gian dài hơn.
5.5. Nước pha loãng cấy vi sinh vật
Thêm từ 5 ml đến 20 ml nước cấy (5.2) (tùy theo loại nguồn nước) vào mỗi lít nước pha loãng (5.4). Giữ nước pha loãng cấy vi sinh vật vừa điều chế ở 20 °C. Chuẩn bị nước này ngay trước khi dùng và đổ bỏ phần dư vào cuối ngày làm việc, trừ khi thực thế phòng thí nghiệm hoặc các giá trị kiểm tra (8.5) cho thấy là dung dịch nước pha loãng cấy vi sinh vật đó dùng được trong khoảng thời gian dài hơn.
Nồng độ khối lượng của oxy bị tiêu thụ qua n ngày ở 20 °C của nước pha loãng cấy vi sinh vật, chính là giá trị trắng (8.3), không được vượt quá 1,5 mg/l.
5.6. Dung dịch axit clohydric (HCl) hoặc dung dịch axit sulfuric (H2SO4), c(H2SO4) » 0,25 mol/l, c(HCl) » 0,50 mol/l, hoặc thích hợp.
5.7. Dung dịch natri hydroxyt (NaOH), p » 20 g/l hoặc thích hợp.
5.8. Dung dịch natri sunfit (Na2SO3), p » 50 g/l hoặc thích hợp.
5.9. Axit glucô – glutamic, dung dịch kiểm tra.
Sấy một ít D-gluco khan (C6H12O6) và một ít axit L-glutamic (C5H9NO4) ở nhiệt độ (105 ± 5) °C trong 1 h. Cân mỗi thứ (150 ± 1) mg, hòa trong nước và pha thành 1 000 ml và lắc đều. Về lý thuyết nhu cầu oxy của dung dịch này là 307 mg/l oxy [BOD5 thực nghiệm là (210 ± 20) mg/l oxy và BOD7 thực nghiệm là (225 ± 20) mg/l oxy].
Chuẩn bị dung dịch này ngay trước khi dùng và đổ bỏ phần còn lại vào cuối ngày làm việc. Một lượng nhỏ dung dịch này có thể giữ đông lạnh. Dung dịch phải được sử dụng ngay sau khi làm tan đông lạnh.
5.10. Dung dịch allylthiorea (ATU), p = 1,0 g/l.
Hòa tan 200 mg allylthiourea (C4H8N2S) trong nước, pha loãng đến 200 ml và lắc đều. Bảo quản dung dịch ở 4 °C. Dung dịch này bền ít nhất hai tuần. Đây là hợp chất độc vì vậy phải cẩn thận.
Mọi dụng cụ thủy tinh cần phải sạch, không hấp thụ các hợp chất độc hoặc chất phân hủy sinh học, luôn được giữ gìn để không bị nhiễm bẩn.
6.1. Bình ủ, bình BOD, có nút đậy, dung tích từ 250 ml đến 300 ml hoặc 100 ml đến 125 ml, có nút mài thủy tinh, và nên dùng loại bình vai thẳng, hoặc bất cứ bình nào tương tự.
Điều quan trọng là các bình phải được làm sạch kỹ tước khi dùng. Nếu sử dụng phương pháp đo iốt [TCVN 7324 (ISO 5813)] để xác định ôxy hòa tan thì thông thường chỉ xúc rửa với nước vòi vài lần là đủ sạch, sau đó rửa với nước đã loại ion. Nếu sử dụng phương pháp điện cực [TCVN 7325 (ISO 5814)] thì quy trình xúc rửa đòi hỏi nghiêm ngặt hơn, ví dụ như sau: cho vào một bình rỗng từ 5 ml đến 10 ml dung dịch tẩy rửa (ví dụ 2,5 g iốt cùng với 12,5 g kali iôđua hòa với mỗi lít axit sufuric 1 %) và lắc kỹ để dung dịch tẩy rửa láng hết thành bình. Để yên 15 min, rót chất tẩy rửa ra khỏi bình và xúc kỹ bình với nước vòi, sau đó xúc rửa bình với nước đã loại ion.
6.2. Bình dùng để pha loãng nước, bình thủy tinh hoặc nhựa/chất dẻo.
Phải áp dụng các biện pháp thích hợp để đảm bảo bình này được bảo quản sạch và không có vi sinh vật phát triển. Kiểm tra để biết bình nhựa không làm tăng các giá trị trắng (8.3).
6.3. Tủ ủ, có khả năng duy trì được nhiệt độ (20 ± 2) °C.
6.4. Thiết bị xác định nồng độ oxy hòa tan, phù hợp với TCVN 7324 : 2004 (ISO 5813) hoặc TCVN 7325 : 2004 (ISO 5814).
6.5. Phương tiện làm lạnh, nhiệt độ 0 °C đến 4 °C, dùng để vận chuyển và lưu giữ mẫu.
6.6. Bình pha loãng, bình thủy tinh có nút đậy, dung tích phụ thuộc vào thể tích mẫu pha loãng sử dụng, vạch chia 2,5 ml và 10 ml, hoặc bất cứ bình nào phù hợp cho việc pha loãng.
6.7. Thiết bị sục khí, chẳng hạn bình chứa khí nén hoặc một máy nén khí.
Chất lượng không khí sục không làm nhiễm bẩn mẫu do sục khí, đặc biệt là làm nhiễm thêm chất hữu cơ, oxy hóa chất khử, hoặc kim loại. Nếu nghi nhiễm bẩn, thì không khí cần được lọc và rửa.
Mẫu được nạp đầy trong một bình kín ngay sau khi lấy mẫu và giữ ở nhiệt độ từ 0 °C đến 4 °C cho đến khi phân tích. Tiến hành xác định BODn càng sớm càng tốt trong vòng 24 h kể từ khi mẫu được lấy. Làm đông lạnh mẫu, xem các trường hợp đặc biệt trong điều 10.
Phải đảm bảo là những chai chứa mẫu không làm tăng giá trị trắng.
8.1. Xử lý sơ bộ
8.1.1. Trung hòa mẫu
Nếu pH của mẫu sau khi pha loãng không nằm trong khoảng 6 và 8, cần dùng dung dịch axit clohydric (5.6) hoặc natri hydroxyt (5.7) để trung hòa mẫu sau khi đã xác định thể tích bằng phép thử riêng. Khi trung hòa không cần quan tâm đến kết tủa nếu có tạo thành.
8.1.2. Clo tự do và/ hoặc clo liên kết
Loại bỏ clo tự do và clo liên kết có trong mẫu bằng dung dịch natri sulfit (5.8). Chú ý không dùng dư.
CHÚ THÍCH Các phương pháp xác định clo tự do và clo liên kết theo ISO 7393-1 và ISO 7393-2.
8.1.3. Đồng nhất mẫu
Đồng nhất mẫu bằng cách làm tan các hạt rắn dùng các máy trộn dùng trong phòng thí nghiệm là không nên áp dụng khi tiến hành các công việc phân tích hàng ngày nhưng có thể sử dụng các máy trộn này khi phân tích với mẫu chứa các hạt lớn và yêu cầu hệ số pha loãng cao.
8.1.4. Sự có mặt của tảo
Mẫu có chứa tảo cần phải lọc để tránh việc tạo ra kết quả cao không bình thường. Kích thước lỗ của cái lọc 1,6 µm là phù hợp. Lọc có thể làm thay đổi cơ bản kết quả BOD cho nên chỉ tiến hành lọc nếu thật sự thấy cần thiết trong đánh giá chất lượng nước. Nếu đã tiến hành lọc thì kích thước lỗ lọc phải được nêu trong báo cáo thử nghiệm
Bảng 1 – Độ pha loãng điển hình để xác định BODn
|
BODn dự đoán mg/l O2 |
Hệ số pha loãng * |
Mẫu nước b |
|
3 đến 6 |
giữa 1,1 và 2 |
R |
|
4 đến 12 |
2 |
R, E |
|
10 đến 30 |
5 |
R, E |
|
20 đến 60 |
10 |
E |
|
40 đến 120 |
20 |
S |
|
100 đến 300 |
50 |
S, C |
|
200 đến 600 |
100 |
S, C |
|
400 đến 1200 |
200 |
I, C |
|
1000 đến 3000 |
500 |
I |
|
2000 đến 6000 |
1000 |
I |
|
a Thể tích mẫu đã pha loãng/ thể tích phần mẫu thử b R: Nước sông; E: Nước cống đô thị đã được xử lý sinh học; S: Nước cống đô thị đã được làm trong hoặc nước thải công nghiệp bị ô nhiễm nhẹ; C: Nước cống đô thị thô (chưa xử lý); I: Nước thải công nghiệp bị ô nhiễm nặng. |
||
8.2. Chuẩn bị dung dịch thử
Để mẫu (hoặc mẫu đã xử lý sơ bộ) ở nhiệt độ khoảng (20 ± 2) °C, nếu cần (tùy thuộc vào nguồn gốc của mẫu) nạp khoảng nửa bình và lắc để tránh quá bão hòa oxy.
Lấy một thể tích phần mẫu thử (hoặc mẫu đã xử lý sơ bộ) cho vào bình pha loãng (6.6) và thêm 2 ml dung dịch allylthiourea (5.10) cho mỗi lit nước đã pha loãng và thêm nước pha loãng cấy vi sinh vật (5.5) đến vạch. Nếu dùng hệ số pha loãng lớn hơn 100, cần thực hiện các loạt pha loãng thành hai hoặc nhiều bước.
Lắc nhẹ để tránh tạo bọt khí.
Lượng oxy tiêu thụ phải ít nhất là 2 mg/l và nồng độ oxy sau khi ủ phải ít nhất là 2 mg/l, mức độ pha loãng phải sao cho sau khi ủ nồng độ oxy hòa tan còn lại sẽ trong khoảng một phần ba và hai phần ba nồng độ ban đầu.
Do khó khăn khi lựa chọn được đúng mức độ pha loãng, nên thực hiện một vài pha loãng khác nhau theo hệ số pha loãng và theo độ pha loãng tương ứng với BODn dự đoán (xem Bảng 1).
Xác định cacbon hữu cơ tổng số (TOC) [xem TCVN 6634 (ISO 8245)], chỉ số permanganat [xem TCVN 6186 (ISO 8467)], hoặc nhu cầu oxy hóa học (COD) [xem TCVN 6491 (ISO 6060)] có thể cung cấp các thông tin hữu ích về vấn đề này.
Bảng 2 chỉ ra các khoảng điển hình cho R, tỷ số BODn/TOC, chỉ số permanganat tùy theo loại mẫu.
Bảng 2 – Giá trị đặt trưng của tỷ số R
|
|
Tổng cacbon hữu cơ BOD/TOC [xem TCVN 6634 (ISO 8245)] |
Chỉ số pecmanganat BOD/Index [xem TCVN 6186 (ISO 8467)] |
Nhu cầu oxy hóa học BOD/COD [xem TCVN 6491 (ISO 6060)] |
|
Nước thải không xử lý |
1,2 đến 2,8 |
1,2 đến 1,5 |
0,35 đến 0,65 |
|
Nước thải đã qua xử lý sinh học |
0,3 đến 1,0 |
0,5 đến 1,2 |
0,20 đến 0,35 |
Có thể lựa chọn giá trị R thích hợp theo Bảng 2 để tính giá trị BODn dự đoán:
BODn = R.y
Trong đó y là nhu cầu oxy hóa học, chỉ số pecmanganat hoặc giá trị TOC.
Cần phải cẩn thận để mẫu là đại diện.
Nếu nghi ngờ có mặt các chất độc đối với vi sinh vật, thì phải thực hiện một vài lần pha loãng mẫu. Nếu kết quả BOD phụ thuộc vào pha loãng, chỉ báo cáo kết quả mà được biết là không bị phụ thuộc vào độ pha loãng. Trong trường hợp này có thể áp dụng nhiều thử nghiệm (xem Phụ lục B).
CHÚ THÍCH 1 Trong một số trường hợp, ảnh hưởng ức chế của clo do các sản phẩm clo không được loại bỏ hết.
CHÚ THÍCH 2 Cách ức chế nitrat hóa không phải đạt hiệu quả trong mọi trường hợp. Thêm nhiều ATU quá 2 mg/l có thể ảnh hưởng đến chuẩn độ Winkler [xem TCVN 7324 (ISO 5813)].
8.3. Phép thử trắng
Tiến hành thử trắng đồng thời với việc xác định, dùng nước pha loãng đã cấy vi sinh vật (5.5) thêm vào 2 mg dung dịch ATU (5.10) cho mỗi lít.
8.4. Cách tiến hành
8.4.1. Đo oxy hòa tan dùng phương pháp chuẩn độ iốt [theo TCVN 7324 (ISO 5813)]
Cứ mỗi lần pha loãng (8.2) nạp đầu vào hai bình ủ (6.1), để cho dung dịch đầy tràn nhẹ. Trong quá trình nạp phải chú ý tránh làm thay đổi hàm lượng oxy của dung dịch.
Để cho các bọt khí bám trong thành bình thoát ra hết. Đậy nút bình, cẩn thận để tránh các bọt khí bị tắc lại.
Chia các bình thành hai loạt, mỗi loạt gồm một bình ứng với từng độ pha loãng và ít nhất một bình là dung dịch trắng (8.3).
Đặt loạt bình thứ nhất chứa dung dịch thử đã hòa loãng (8.2) vào tủ ủ (6.3) và để nơi tối trong n ngày ± 4 h.
Tại điểm “không”, nồng độ oxy hòa tan trong loạt bình thứ hai chứa dung dịch thử đã pha loãng bằng phương pháp quy định trong TCVN 7324 (ISO 5813) có bổ sung azid từ thuốc thử iôđua-azid kiềm.
Sau khi ủ xong, xác định nồng độ oxy hòa tan trong từng bình, bằng phương pháp quy định trong TCVN 7324 (ISO 5813).
8.4.2. Đo oxy hòa tan dùng phương pháp đầu dò điện cực [theo TCVN 7325 (ISO 5814)]
Cứ mỗi độ pha loãng (8.2) nạp đầy vào một bình ủ (6.2), để cho dung dịch đầy tràn nhẹ. Trong quá trình nạp phải chú ý tránh làm thay đổi hàm lượng oxy của dung dịch.
Để cho các bọt khí bám trong thành bình thoát ra hết.
Đo nồng độ oxy hòa tan trong từ bình tại điểm “không” bằng phương pháp quy định trong TCVN 7325 (ISO 5814).
Đậy nút bình, cẩn thận để tránh các bọt khí bị tắc lại.
Đặt các bình chứa dung dịch thử đã pha loãng (8.2) vào buồng ủ (6.3) và để nơi tối trong n ngày ± 4 h.
Sau khi ủ, xác định nồng độ oxy hòa tan trong mỗi bình, dùng phương pháp quy định trong TCVN 7325 (ISO 5814).
8.5. Phép thử kiểm tra
Để kiểm tra nước pha loãng cấy vi sinh vật, nước cấy và kỹ thuật của người phân tích, tiến hành phép thử kiểm tra theo từng lô mẫu bằng cách đổ 20,00 ml dung dịch kiểm tra axit glucô-glutamic (5.9) vào bình pha loãng, thêm 2 ml dung dịch ATU (5.10) rồi pha loãng thành 1 000 ml với nước pha loãng cấy vi sinh vật (5.5) và tiến hành theo 8.4.
Kết quả BODn thu được phải nằm trong khoảng (210 ± 40) mg/l oxy với BOD5 và (225 ± 40) mg/l oxy với BD7, tương ứng với khoảng giá trị trung bình ± 2x độ lệch chuẩn xác định được từ dữ liệu liên phòng thí nghiệm (xem điều 10). Giới hạn kiểm tra độ chính xác cho từng phòng thí nghiệm cần được thiết lập bằng tiến hành tối thiểu 25 phép xác định trong quãng thời gian ít nhất là vài tuần. Giá trị trung bình và độ lệch chuẩn có thể được dùng để tính toán giới hạn kiểm soát đối với kiểm tra kiểm soát chất lượng. Nếu không, thì kiểm tra lại nước cấy và nếu cần thì kiểm tra kỹ thuật của người phân tích.
Phép thử trắng (8.3) không được vượt quá 1,5 mg/l oxy nếu vượt thì kiểm tra nguồn gốc nhiễm bẩn có thể có.
9. Tính toán và thể hiện kết quả
9.1. Kiểm tra sự tiêu thụ oxy trong quá trình thử nghiệm
BODn được tính toán cho các dung dịch thử, khi các điều kiện sau thỏa mãn:
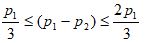
Trong đó
p1 là nồng độ oxy hòa tan của một trong các dung dịch thử ở điểm “không”, tính bằng miligam trên lít;
p2 là nồng độ oxy hòa tan của chính dung dịch thử sau n ngày, tính bằng miligam trên lít;
9.2. Tính toán nhu cầu oxy sinh hóa sau n ngày (BODn)
Nhu cầu oxy sinh hóa (BODn), tính bằng miligam oxy trên lít, theo công thức sau:
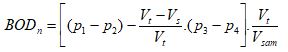
Trong đó
p1 và p2 xem ở 9.1;
p3 là nồng độ oxy hòa tan của dung dịch mẫu trắng ở điểm “không”, tính bằng miligam trên lít;
p4 là nồng độ oxy hòa tan của dung dịch mẫu trắng sau n ngày, miligam trên lít;
Vsam là thể tích của mẫu dùng để chuẩn bị dung dịch thử, tính bằng mililít;
V1 là tổng thể tích của dung dịch thử đó, tính bằng mililít.
Nếu một số bước pha loãng đạt kết quả nằm trong khoảng yêu cầu, tính giá trị trung bình của các kết quả thu được của các mức pha loãng đó.
Kết quả được biểu thị bằng miligam trên lít oxy. Kết quả nhỏ hơn 10 mg/l oxy thì lấy chính xác đến mg/l. Kết quả nằm trong khoảng từ 10 mg oxy/l đến 1 000 mg/l thì lấy để hai chữ số có nghĩa.
Kết quả lớn hơn 1 000 mg oxy/l thì cần lấy đến ba chữ số có nghĩa, ví dụ: 1 240 mg/l oxy.
Các kết quả của phép thử liên phòng thí nghiệm về độ đúng và độ chính xác của kết quả được nêu trong Phụ lục C.
Nếu khoảng thời gian giữa lấy mẫu và bắt đầu phân tích không đảm bảo dưới 24 h, vì thời gian vận chuyển, hoàn cảnh địa hình thì cho phép làm đông lạnh mẫu. Mẫu đông lạnh cần phải đồng nhất hóa sau khi rã đông và trong tất cả mọi trường hợp đều phải sử dụng nước cấy. Khuyến nghị rằng khi có thể, cần sử dụng các cơ sở phòng thí nghiệm tại chỗ được hạn chế thời gian vận chuyển.
Báo cáo thử nghiệm gồm các thông tin sau:
a) Viện dẫn tiêu chuẩn này;
b) Kỹ thuật đã tiến hành ức chế sự nitrat hóa, nếu dùng;
c) Số ngày ủ (n);
d) Kết quả, tính bằng miligam trên lít oxy (báo cáo kết quả như trình bày trong 9.2);
e) Những kết quả ở dưới khoảng yêu cầu, phần giải thích cho giới hạn phát hiện tương ứng;
f) Những chi tiết đặc biệt đã từng được ghi nhận trong quá trình thử nghiệm;
g) Những chi tiết về các thao tác mà không quy định trong tiêu chuẩn này, TCVN 6001-1 : 2007 (ISO 5815-1 : 2003), hoặc xem như tùy chọn như lọc (8.1.4) làm đông lạnh và đồng nhất mẫu (xem điều 10), thời gian ủ thay đổi (BOD2+5) (xem Phụ lục A) và thử nghiệm nhiều lần (xem Phụ lục B).
(tham khảo)
Tốc độ oxy hóa cacbon trong giai đoạn đầu thử BOD có thể biểu diễn bằng định luật Phelps:
Trong đó:
L là giá trị BOD cuối cùng ở thời điểm bất kỳ, tính bằng miligam trên lít oxy;
x là giá trị BOD ở thời điểm t, tính bằng miligam trên lít oxy;
t là thời gian, tính bằng ngày;
k là hằng số tốc độ, tính bằng đại lượng nghịch đảo của ngày.
Đối với một loại hợp chất hữu cơ và chất cấy vi sinh cho trước, hiệu ứng của nhiệt độ đến hằng số tốc độ k và giá trị L có thể dự đoán được ở mức độ gần đúng đầu tiên. Điều đó rất có ích khi xem xét phép thử BOD ở những vùng khí hậu ấm hoặc khi nghiên cứu những con sông dài chảy qua nhiều vùng khí hậu. Tuy nhiên, khi dùng mối tương quan này phải rất thận trọng.
BOD tiêu chuẩn là kết quả thu được sau năm ngày hoặc bảy ngày ủ ở 20 °C.
Bằng việc ủ trong hai ngày tại 0 °C đến 4 °C tiếp theo đó là năm ngày ở 20 °C, thu được kết quả BOD2+5. Quan sát thu được cho thấy là không có sự khác biệt đáng kể giữa BOD5 và BOD2+5 sau khi pha loãng mẫu.
Điều này cũng đã phát hiện ra từ một so sánh liên phòng thí nghiệm ở châu Âu thực hiện trong năm 1992 với 95 phòng thí nghiệm từ 11 nước tham gia. Mối tương quan giữa phép xác định BOD5 và BOD7 và phép xác định BOD5 và BOD2+5 đã được đo. Kết quả này được trình bày ở Bảng A.1
Bảng A.1 – So sánh BOD5 và BOD2+5 của liên phòng thí nghiệm
|
|
Loại mẫu |
Dung dịch Glucô/axit glutamic |
Nước thải đã xử lý cơ học |
Nước thải đã xử lý sinh học |
|||
|
A |
B |
C |
D |
E |
F |
||
|
BOD5 |
Giá trị trung bình, mg/l oxy |
203 |
184 |
58 |
46 |
18,2 |
17,2 |
|
|
Giá trị trung bình, mg/l oxy |
201 |
180 |
58 |
46 |
18,1 |
17,2 |
|
BOD2+5 |
Sự khác biệt với BOD5 b |
Không |
Không |
Không |
Không |
Không |
Không |
|
|
Số lần thử nghiệm |
91 |
85 |
89 |
86 |
89 |
87 |
|
a Mức ý nghĩa a = 0,05. |
|||||||
Trong thực tế là không có sự khác biệt giữa các kết quả BOD5 và BOD2+5.
Khi xác định BOD2+5, bổ sung thêm nội dung (8.4.1) với thay đổi như sau ở đoạn 4:
"Đặt loạt bình thứ nhất chứa dung dịch thử đã pha loãng (8.2) vào chỗ tối ở nhiệt độ (0 đến 4) °C trong 2 ngày ± 2 h (1) và sau đó đặt vào buồng ủ (6.3) và để yên trong tối ở nhiệt độ (20 ± 1) °C trong 5 ngày ± 2 h1)"
Và bổ sung thêm nội dung (8.4.2) với thay đổi như sau của đoạn 5:
"Đặt các bình chứa dung dịch thử đã pha loãng (8.2) vào chỗ tối ở nhiệt độ (0 đến 4) °C trong 2 ngày ± 2 h 1), và sau đó đặt vào buồng ủ (6.3) và để yên trong tối ở nhiệt độ (20 ± 1) °C trong 5 ngày ± 2h 1)".
Khi tiến hành các phép xác định BOD2+5 thay thế cho các phép xác định BOD5, phòng thí nghiệm cần phải kiểm tra quy trình xác định BOC2+5 của mình cho ra kết quả tương đương với kết quả xác định BOD5.
(tham khảo)
Thử nghiệm nhiều lần là phép phân tích một mẫu với hai hoặc nhiều hơn hai lần pha loãng khác nhau. Quy trình này có thể dùng để tăng độ chính xác mong muốn, hoặc do nghi ngờ trong mẫu có mặt các chất độc đối với vi sinh vật.
Mẫu được phân tích như trình bày trong 8.4 với ngoại lệ là bổ sung thêm mỗi bình đựng từng mức pha loãng mẫu và như vậy là có hai bình BOD được ủ.
Sự tiêu thụ oxy trong quá trình ủ được xác định cho từng bình BOD và lập biểu đồ dựa theo thể tích của mẫu theo từng độ pha loãng mẫu.
Lập biểu đồ sự tiêu thụ oxy của phép thử trắng thì giá trị thể tích coi là bằng “không” (zero).
Nếu sự tiêu thụ oxy tính theo thể tích mẫu là tuyến tính, thì BODn không chứa các thành phần ức chế vi sinh vật.
Nếu sự tiêu thụ oxy tính theo thể tích mẫu chỉ tuyến tính khi nồng độ mẫu là thấp, thì chỉ các mẫu pha loãng nằm trong dãy tuyến tính mới được sử dụng để phân tích BODn.
BODn được tính như trong điều 9, và đó là giá trị trung bình của tất cả các xác định nằm trong dãy tuyến tính.
(tham khảo)
Độ đúng và độ lệch chuẩn của độ tái lập và lặp lại của phân tích BODn đã được một so sánh liên phòng thí nghiệm xác định năm 1992. Trong thực hành này ba cặp mẫu đã được 95 phòng thí nghiệm thuộc 11 quốc gia phân tích. Kết quả được trình bày trong Bảng C.1.
Bảng C.1 – Kết quả so sánh liên phòng thí nghiệm
|
|
Mẫu |
Giá trị đã tính được/hiệu số mg/l oxy |
Trung vị mg/l oxy |
Độ lệch chuẩn lặp lại mg/l oxy |
Trung bình sai khác mg/l oxy |
Độ lệch chuẩn tái lập của sai khác mg/l oxy |
Số kết quả |
Giá trị ngoại lai |
||
|
BOD5 |
Dung dịch gluco/axit A glutamic |
199 |
- 19 |
203 |
22 |
-18 |
11 |
91 |
5 |
|
|
Dung dịch gluco/axit B glutamic |
180 |
184 |
19 |
|
|
|||||
|
Nước thải đã xử lý cơ học C |
|
58,3 |
7,7 |
|
|
95 |
5 |
|||
|
Nước thải đã xử lý cơ học D |
|
40,0 |
5,0 |
|
|
|
|
|||
|
Nước thải đã xử lý sinh học E |
|
18,2 |
4,5 |
|
|
95 |
5 |
|||
|
Nước thải đã xử lý sinh học F |
|
17,2 |
3,7 |
|
|
|
|
|||
|
BOD2+5 a |
Dung dịch gluco/axit A glutamic |
199 |
- 19 |
201 |
24 |
-17 |
11 |
88 |
2 |
|
|
|
Dung dịch gluco/axit B glutamic |
180 |
180 |
24 |
|
|
||||
|
|
Nước thải đã xử lý cơ học C |
|
58,0 |
8,9 |
|
|
90 |
4 |
||
|
|
Nước thải đã xử lý cơ học D |
|
45,5 |
6,0 |
|
|
|
|
||
|
|
Nước thải đã xử lý sinh học E |
|
18,1 |
4,9 |
|
|
91 |
3 |
||
|
|
Nước thải đã xử lý sinh học F |
|
17,2 |
4,2 |
|
|
|
|
||
|
BOD7 |
Dung dịch gluco/axit A glutamic |
213 |
- 20 |
210 |
22 |
-19 |
-13 |
88 |
3 |
|
|
|
Dung dịch gluco/axit B glutamic |
193 |
190 |
19 |
|
|
||||
|
|
Nước thải đã xử lý cơ học C |
|
64,4 |
8,6 |
|
|
91 |
6 |
||
|
|
Nước thải đã xử lý cơ học D |
|
51,6 |
6,7 |
|
|
|
|
||
|
|
Nước thải đã xử lý sinh học E |
|
19,3 |
5,0 |
|
|
92 |
4 |
||
|
|
Nước thải đã xử lý sinh học F |
|
17,8 |
4,3 |
|
|
|
|
||
|
a Xem phụ lục A |
||||||||||
Có thể lập hệ số chuyển đổi giữa số liệu BOD5 và BOD7 trong cùng một loại nước. Giá trị hệ số chuyển đổi có thể thu được từ các phân tích song song BOD5 và BOD7 với các phép đo cùng một mẫu. Nếu không có hệ số chuyển đổi thì hiệu chỉnh giữa BOD5 và BOD7 có thể tính ra từ các kết quả của so sánh liên phòng thí nghiệm đề cập trên đây. Kết quả so sánh này cho ở Bảng C.2.
Độ chính xác của phân tích BODn ngày có thể cải thiện được nếu cần, thông qua thử nghiệm nhiều lần (xem Phụ lục B).
Bảng C.2 – So sánh BOD5 và BOD7 liên phòng thí nghiệm
|
Loại mẫu |
|
BOD5 mg/l oxy trung vị |
BOD7 mg/l oxy trung vị |
Sai khác có ý nghĩa |
Số các phòng thí nghiệm |
BOD7/ BOD5 |
|
Dung dịch axit gluco/glutamic |
A |
203 |
210 |
có |
90 |
1,04 |
|
|
B |
184 |
190 |
có |
87 |
1,03 |
|
Nước thải đã xử lý cơ học |
C |
58 |
64 |
có |
88 |
1,10 |
|
|
D |
46 |
52 |
có |
88 |
1,12 |
|
Nước thải đã xử lý sinh học |
E |
18,2 |
19,3 |
có |
87 |
1,06 |
|
|
F |
17,2 |
17,8 |
có |
89 |
1,03 |
|
a Mức ý nghĩa, a = 0,05. |
||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 5981-2 (ISO 6107-2:1997) Chất lượng nước – Từ vựng – Phần 2.
[2] ISO 7393-1: 1985, Water quality- Determination of free chlorine and total chlorine – Part 1: Titrimetric method using N,N-diethyl-1,4-phenylenediamine (Chất lượng nước – Xác định clo tự do và clo tổng số - Phần 1: Phương pháp chuẩn độ sử dụng N,N-diethyl-1,4-phenylenediamin)
[3] ISO 7393-2: 1985, Water quality- Determination of free chlorine and total chlorine – Part 2: Colorimetric method using N,N-diethyl-1,4-phenylenediamine, for routine control purposes (Chất lượng nước – Xác định clo tự do và clo tổng số - Phần 2: Phương pháp đo màu sử dụng N,N-diethyl-1,4-phenylenediamin, dùng cho mục đích kiểm soát thường nhật)
[4] TCVN 6827 : 2001 (ISO 9484 : 1999) Chất lượng nước – Đánh giá sự phân hủy sinh học hiếu khí hoàn toàn các hợp chất hữu cơ trong môi trường bằng cách xác định nhu cầu oxy trong máy đo hô hấp kín.
1) Nếu sử dụng cùng một tủ để bảo quản tại cả hai mức nhiệt độ, nên sử dụng tủ ủ có quạt hỗ trợ để đảm bảo rằng sự thay đổi nhiệt độ ủ nằm trong khoảng thời gian ngắt yêu cầu là 2 h giữa hai lần ủ.