Công thức tính nồng độ phần trăm và những điều bạn cần lưu ý
Hiện nay, trên các diễn đàn mạng xã hội, rất nhiều độc giả tìm kiếm công thức tính C, công thức tính nồng độ phần trăm (C%). Thực tế tính C hay còn gọi là tính C% không khó, tuy nhiên để thao tác thực hiện nhanh chóng và chính xác, càn tuân thủ đúng công thức và những lưu ý của công thức. Hãy cùng chúng tôi khám phá chi tiết qua bài viết dưới đây.
Thông tin chung về nồng độ và nồng độ phần trăm
Hiểu một cách đơn giản nhất, nồng độ là một cách mô phỏng đơn giản hóa thành phần của một hỗn hợp bất kỳ. Ví dụ, trong không khí có chứa 1% khí nitơ thì 1% đó chính là nồng độ.
Nồng độ có nhiều khái niệm khác nhau, trong đó một số khái niệm thường dùng bao gồm:
- Nồng độ phần trăm của khối lượng.
- Nồng độ phần trăm của thể tích.
- Nồng độ mol.
- Nồng độ phân tử gam.
- Nồng độ chuẩn.
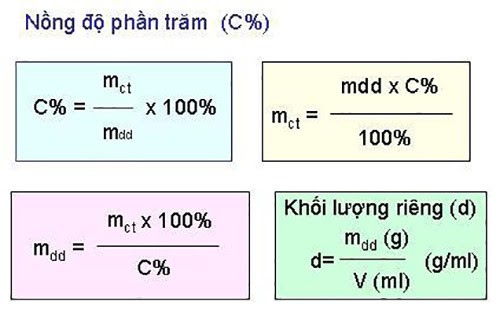
Nồng độ phần trăm được xác định của 1 dung dịch chính là là 1 đại lượng cho biết trong 100 gam dung dịch đó sẽ có bao nhiêu gam chất tan. Nồng độ phần trăm kí hiệu là C%.
Các công thức tính C% (nồng độ phần trăm)
Một số công thức tính nồng độ phần trăm cụ thể như sau:
Công thức tính C% theo khối lượng
Hiểu một cách đơn giản nhất, phần trăm theo khối lượng (m/m) thực chất là phép tính của khối lượng chất tan chia cho tổng khối lượng của dung dịch. Sau đó nhân kết quả có được với 100%.
Phần trăm theo khối lượng = khối lượng chất tan/tổng khối lượng dung dịch ×100%
Công thức tính nồng độ phần trăm theo khối lượng
Ví dụ cụ thể như sau:
Câu hỏi: Tính phần trăm khối lượng của dung dịch. Biết trong 500g dung dịch đó chứa 26,5g glucose.
Bài làm:
- Theo công thức ta có: Phần trăm theo khối lượng = khối lượng glucose/tổng khối lượng dung dịch×100% = 26,5g
- 500g × 100% = 5,30%
Công thức tính C% theo thể tích
Hiểu một cách đơn giản nhất, phần trăm theo thể tích (v/v) là thể tích chất tan chia cho tổng thể tích dung dịch. Sau đó kết quả nhân với 100%.
Phần trăm theo khối lượng = thể tích chất tan/tổng thể tích dung dịch × 100%
Các bước giải bài tập tính nồng độ phần trăm
Tính nồng độ phần trăm là một dạng bài tập khá phức tạp của môn Hóa. Tuy nhiên nếu hiểu đúng bản chất của công thức và áp dụng công thức tính C một cách chính xác, việc giải bài tập dạng này không khó.
Mách bạn các bước chi tiết để áp dụng công thức tính C và giải bài tập tính nồng độ phần trăm nhanh và chính xác
Bạn đọc hãy cùng áp dụng các bước giải chi tiết dưới đây để có kết quả nhanh và chính xác nhất nhé:
- Bước 1: Đọc kĩ đề bài và xác định số chất có trong dung dịch. Lưu ý quan tâm đặc biệt tới đến số dư của các chất tham gia phản ứng.
- Bước 2: Tìm khối lượng dung dịch sau khi tham gia phản ứng. Công thức tìm cụ thể như sau:
mdd = khối lượng các chất tan cho vào dung dịch + khối lượng dung môi – khối lượng chất kết tủa – khối lượng chất khí
- Bước 3: Tìm khối lượng chất tan trong dung dịch. Việc tìm khối lượng chất tan sẽ là tiền đề để người làm có thể tiến hành tìm nồng độ phần trăm.
- Bước 4: Tính C% theo công thức tính nồng độ phần trăm.
Lưu ý khi tính nồng độ phần trăm của dung dịch
Mách bạn những lưu ý khi áp dụng công thức tính C để có kết quả nhanh và chính xác nhất
Khi tính C, bên cạnh việc áp dụng công thức đúng chuẩn, cần lưu ý một số yếu tố sau để có thể có kết quả nhanh và chính xác:
- Đọc kỹ đề bài, xác định đúng dạng đề.
- Xác định chi tiết các thành phần đề bài đã cho, xác định những thành phần cần phải cải thiện để thuận tiện trong tính toán.
- Thuộc và áp dụng đúng dạng công thức.
- Tính toán cẩn thận, chi tiết.
- Kiểm tra lại các bước tính toán trước khi đưa ra kết quả cuối cùng.
Mối quan hệ giữa nồng độ phần trăm (C%) và các nồng độ dung dịch khác
Công thức tính C% là công thức độc lập. Tuy nhiên giữa nồng độ phần trăm và các nồng độ dung dịch khác luôn có mối quan hệ tác động qua lại hai chiều lẫn nhau. Cùng tìm hiểu chi tiết về các mối quan hệ này ngay dưới đây:
Mối quan hệ chi tiết giữa nồng độ phần trăm và nồng độ của các dung dịch khác
Mối quan hệ giữa nồng độ phần trăm (C%) và nồng độ mol (CM)
Mối quan hệ giữa nồng độ phần trăm (C%) và nồng độ mol (CM) được xác định bởi công thức:
CM = 10 x d x C% x M
Trong đó:
- M: khối lượng phân tử chất tan.
- CM: nồng độ mol của dung dịch.
- d: khối lượng riêng của dung dịch.
- C%: nồng độ phần trăm của dung dịch.
Mối quan hệ giữa nồng độ phần trăm (C%) và nồng độ đương lượng (CN)
Mối quan hệ giữa nồng độ phần trăm (C%) và nồng độ đương lượng (CN) được xác định bởi công thức:
CN = 10 x d x C% x D
Trong đó:
- D: đương lượng gam
- d : khối lượng riêng của dung dịch.
- CN: nồng độ tương đương của dung dịch
- C%: nồng độ phần trăm của dung dịch.
Cách tính toán tỷ lệ phần trăm tập trung
Trong hóa học, tỷ lệ C% sẽ cho biết bao nhiêu thành phần hoạt chất cụ thể có trong hoặc bao nhiêu thành phần hoạt chất cụ thể cần phải có trong một giải pháp tổng thể. Do đó, không chỉ tính riêng lẻ nồng độ phần trăm theo công thức tính C đã nêu trên mà còn phải có công thức và lưu ý khi tính tỷ lệ phần trăm tập trung.
Nồng độ phần trăm thông thường sẽ được biểu thị là 1: 100, 1: 200, … Ngoài ra cũng có thể biểu thị bằng cách chuyển đổi thành một phần, đặt số thứ nhất lên trên số thứ hai.
Trên đây là những chia sẻ chi tiết về công thức tính C và những thông tin có liên quan đến cách tính nồng độ phần trăm. Bài viết hy vọng đã mang đến cho quý bạn đọc những thông tin hữu ích. Bạn đọc hãy tham khảo chi tiết các công thức, có sự tính toán phù hợp để nồng độ phần trăm nói riêng và môn Hóa học nói chung không còn là những nỗi lo lắng, phức tạp.